宁波市镇海区中医医院 重症医学科,浙江 宁波 315200
【摘要】目的:探究血必净注射液对脓毒症急性肾功能损伤的临床应用价值及作用机制。方法:选取大鼠肾小管上皮细胞,培养后分为正常组、LPS组、血必净组,LPS组、血必净组细胞使用LPS刺激1h,血必净组细胞在LPS刺激后添加血必净注射液进行干预。酶联免疫吸附实验法检测IL-6、TNF-α、GSH、SOD、caspase3活性及细胞凋亡,MTT法检测细胞增殖活性,逆转录聚合酶链反应(RT-PCR)检测IL-6, TNF-a mRNA水平变化,Western blotting检测IL-6, TNF-a 蛋白水平变化。结果:与正常细胞比较,LPS组细胞与血必净组细胞增值率相对较低,凋亡率相对较高(P<0.05)。与LPS组细胞比较,血必净组细胞增殖率较高,凋亡率较低(P<0.05)。与正常组细胞比较,LPS组、血必净组细胞caspase3相对表达量较低(P<0.05);与LPS组细胞比较,血必净组细胞caspase3相对表达量较高(P<0.05)。与LPS组细胞比较,血必净组细胞IL-6、TNF-α水平较低,GSH、SOD水平较高(P<0.05)。结论:使用血必净注射液对LPS处理的肾小管上皮细胞进行干预,能够减轻炎症反应、氧化应激损伤,促进肾小管上皮细胞增殖,抑制肾小管上皮细胞凋亡,其作用机制可能为使用血必净注射液进行干预能够调控线粒体凋亡通路相关蛋白表达,从而在脓毒症相关急性肾损伤中起到肾脏保护作用。
【关键词】脓毒症相关急性肾损伤;血必净注射液;线粒体功能;细胞凋亡
Regulation of mitochondrial function by Xuebijing in sepsis associated acute kidney injury
【Abstract】ObjectiveTo investigate the clinical application value and mechanism of Xuebijing Injection on acute kidney function injury in sepsis. MethodsSelected rat kidney tubular epithelial cells were pided into normal, LPS, and Xuebijing groups after culture. Cells from the LPS and Xuebijing groups were stimulated with LPS for 1 hour, and cells from the Xuebijing group received the intervention by adding Xuebijing injection after LPS stimulation.The levels of IL-6, TNF-α, GSH, SOD, relative expression of Caspase3 and relative apoptosis were determined by enzyme-linked immunosorbent assay, cell viability was determined by MTT assay, the mRNA levels of IL-6 and TNF-α was determined by Reverse transcription polymerase chain reaction (RT-PCR), and the protein levels of IL-6 and TNF-α was determined by Western blotting assay. ResultsCompared with the cells in the LPS group, the cells in Xuebijing group showed higher proliferation rates and lower apoptosis rates (P<0.05). The relative expression levels of Caspase3 were lower (P<0.05) in the LPS group than in the normal cells, and the relative expression levels of Caspase3 were higher (P<0.05) in the cells from Xuebijing group compared with the cells from LPS group. Compared with cells from the LPS group, cells from Xuebijing group had lower levels of IL-6 and TNF-α, and higher levels of GSH and SOD (
P<0.05).ConclusionIntervention of LPS treated tubular epithelial cells with Xuebijing injection was able to reduce inflammatory responses, oxidative stress injury, promote tubular epithelial cell proliferation, and inhibit tubular epithelial cell apoptosis. The mechanism of action may be that Xuebijing injection can regulate the expression of proteins related to mitochondrial apoptosis pathway. Thus, it plays a role in kidney protection in sepsis associated acute kidney injury.
【Key words】Sepsis associated acute kidney injury;Xuebijing injection;Mitochondrial function;Apoptosis
引言
临床上将感染等因素诱发免疫应答失衡、炎症反应而导致的机体器官功能性障碍的症状定义为脓毒症,严重威胁患者身体健康甚至生命安全[1-2]。急性肾损伤是一种临床常见的综合征,主要表现为机体肾脏组织血液再分布、肾小管坏死等[3]。有研究表示,急性肾损伤的发生发展是多种因素共同作用的结果,其中脓毒症是急性肾损伤发生的主要危险因素[4]。据不完全统计,半数以上的脓毒症患者治疗过程中会出现急性肾损伤症状。脓毒症相关急性肾损伤具有发病急、病情进展快、恶性程度高、治疗难度大的特点,患者预后较差,因此寻找一种安全有效的治疗脓毒症相关急性肾损伤的手段称为医疗领域的重点研究方向[5-6]。血必净注射液具有体外拮抗内毒素的作用,常用于机体全身炎症反应综合征、多器官功能障碍综合征的治疗[7]。本研究设计细胞实验,旨在探究血必净注射液对脓毒症急性肾功能损伤的临床应用价值及作用机制。
1 材料与方法
1.1 材料
研究细胞:大鼠肾小管上皮细胞NRK-52E:上海细胞库提供。
培养所用材料:胎牛血清(FBS):Sigma 公司
青霉素:Sigma 公司
链霉素:Sigma 公司
主要试剂:大鼠抗兔IL-6、TNF-α抗体:Sigma 公司;
兔抗大鼠GSH、SOD、MDA、ROS抗体:Abcam公司;
caspase-3 活性检测试剂盒:Abcam公司;
Apoptotic Nucleosome ELISA 检测试剂盒:Roche公司
1.2 方法
1.2.1 细胞培养及分组处理
取冻存的肾小管上皮细胞,40℃环境中火浴处理,充分摇晃均匀后将其置于2mL培养基(100g/L青霉素、链霉素及10%胎牛血清)内,进行离心处理,3000r/min,重悬处理后进行细胞传代,将细胞培养基置于5% CO2培养箱中培养。将肾小管上皮细胞分为正常组、LPS组、血必净组,正常组细胞正常培养,不做其他处理,LPS组、血必净组细胞使用不同浓度LPS刺激1h,血必净组细胞在LPS刺激后添加不同浓度血必净注射液孵育1d。各组细胞上述处理方式均重复2次。
1.2.2 指标检测
1.2.2.1 细胞增殖活性及凋亡能力检测
MTT法检测细胞增殖:将各组细胞加入96孔板中,每孔中加入30ul的MTT液,37℃孵育4小时,弃培养液,加入150ul的DMSO,酶标仪在498波长处检测每孔的OD值。
ELISA法检测细胞凋亡:按照Apoptotic Nucleosome ELISA检测试剂盒说明书操作。方法:从冰箱取出试剂盒,室温复温平衡30分钟。用蒸馏水将20倍浓缩洗涤液稀释成原倍的洗涤液。取足够数量的酶标包被板,固定于框架上,分别设置标准品孔、待测样本孔和空白对照孔,记录各孔位置,在标准品孔中加入标准品50μL;待测样本孔中先加入待测样本10μL,再加样本稀释液40μL(即样本稀释5倍);空白对照孔不加。37℃温育30min。洗板、拍干,每孔加满洗涤液,静置1min,甩去洗涤液,拍干,重复洗板4次。每孔加入酶标工作液50μL,空白对照孔不加。37℃温育30min。每孔先加入显色剂A 液50μL,再加入显色剂B液 50μL,混匀30s,37℃避光显色15min。取出酶标板,每孔加终止液50μL,终止反应(颜色由蓝色立转黄色)。以空白孔调零,在终止后15分钟内,用450nm波长测量各孔的吸光值(OD值)。
1.2.2.2 IL-6、TNF-α及GSH、SOD等氧自由基检测
ELISA法检测:方法同上,检测IL-6、TNF-α及氧自由基水平。
Western blot法检测IL-6、TNF-α 相对蛋白表达量:提取50ug蛋白,煮沸5min使蛋白变性后用SDS-PAGE凝胶电泳,然后依据蛋白分子大小把凝胶切开并转移至PVDF膜上,用Western封闭液把待测蛋白和内参蛋白封闭90min在室内,按1:1000加到待测蛋白抗体,内参抗体以1:2000加入,孵育过夜,使用Western洗涤液洗涤5次,每10min 1次。按1:5000加入稀释山羊抗兔IgG,孵育60min室温水平摇床,洗涤5次Western洗涤液,每10min 1次。经过ECL显色和曝光后,进行BIO-RAD成像,使用Image J图像分析系统检测条带的灰度值,以内参条带灰度值与蛋白比值为结果统计分析。
1.2.2.3 线粒体凋亡通路蛋白相对表达量检测
使用Apoptotic Nucleosome ELISA试剂盒检测caspase3活性水平:取出适量的Ac-DEVD-pNA 和2×反应液,置于冰浴上备用。使用前每50ul 2×反应液加入0.5ul DTT。吸取50ul含100~200μg蛋白的细胞或组织裂解上清。加入Ac-DEVD-pNA 后混匀,37℃孵育4h。酶标仪在波长400或405nm出测定吸光值OD。通过计算OD比值来确定Caspase-3活化程度。
1.2.2.4 IL-6, TNF-a mRNA水平变化检测
逆转录聚合酶链反应(RT-PCR)法检测:1.总RNA的提取:采用RNA提取试剂盒。2. cDNA第一链的合成:在0.5ml微量离心管中,加入总RNA 1-5ug,补充适量的DEC H2O使总体积达11ul。在管中加10uM Oligo(dT)12-18 1ul,轻轻混匀、离心。70℃加热10min,立即将微量离心管插入冰浴中至少1min。然后加入下列试剂的混合物:10×PCR buffer 2ul;25mM MgCl2 2ul;10mM dNTPmix 1ul;0.1M DTT 2ul,轻轻混匀、离心,42℃孵育2-5min。加入SuperscriptⅡ1ul,在42℃水浴中孵育50min,于70℃加热15min以终止反应。将管插入冰中,加入RNase H 1ul,37℃孵育20min,降解残留的RNA。-20℃保存备用。3.PCR:
取0.5ml PCR管,依次加入下列试剂:第一链cDNA 2ul;上游引物(10pM) 2ul;下游引物(10pM)2ul;dNTP(2mM) 4ul;10×PCR buffer 5ul;Taq 酶(2u/μl) 1ul。加入适量的ddH2O,使总体积达50μl。轻轻混匀,离心。设定PCR程序。扩增30个循环。琼脂糖凝胶电泳,紫外灯下观察结果,对电泳条带进行密度扫描。
1.3 统计学处理
使用SPSS 23.0软件,计量资料以(![]() )描述,多组对比行F值检验,组间对比行独立样本t检验,P<0.05为具有统计学差异。
)描述,多组对比行F值检验,组间对比行独立样本t检验,P<0.05为具有统计学差异。
2结果
2.1LPS处理肾小管上皮细胞NRK-52E模型的建立。
LPS处理肾小管上皮细胞NRK-52E可以模拟炎症损伤。与正常组细胞比较,LPS组细胞增值率相对较低,凋亡率相对较高(P<0.05)。同时,与正常组细胞比较,LPS组细胞炎症银子IL-6, TNF-a表达显著升高(P<0.05)。(见图1)

图1LPS处理大鼠肾小管上皮细胞后与正常组比较
A用不同浓度的LPS处理完NRK-52E细胞24小时后,MTT法检测细胞活性。B. NRK-52E细胞用LPS (1ug/ml)处理24小时后,利用Apoptotic Nucleosome ELISA 试剂盒(Roche, Basel, Switzerland)检测细胞凋亡程度变化。C.NRK-52E细胞用LPS (1ug/ml)处理24小时后,利用caspase-3 活性检测试剂盒检测caspase-3活性变化。D. NRK-52E细胞用LPS (1ug/ml)处理24小时后,RT-PCR法检测炎症相关因子IL-6, TNF-a mRNA水平变化。E.NRK-52E细胞用LPS (1ug/ml)处理24小时后,Western blotting检测培养基中炎症相关因子IL-6, TNF-a 蛋白水平变化。F.NRK-52E细胞用LPS (1ug/ml)处理24小时后,ELISA法检测培养基中炎症相关因子IL-6, TNF-a 蛋白水平变化。(注:与正常组相比,*P<0.05;**P<0.01)
2.2 血必净对于肾小管上皮细胞NRK-52E的作用
与LPS组细胞比较,血必净组细胞增殖率较高,凋亡率较低(P<0.05)。与正常组细胞比较,LPS组、血必净组细胞caspase3相对表达量较低(P<0.05);但与LPS组细胞比较,血必净组细胞caspase3相对表达量较高(P<0.05)。与LPS组细胞比较,血必净组细胞IL-6、TNF-α表达水平较低(
P<0.05)。(见图2)
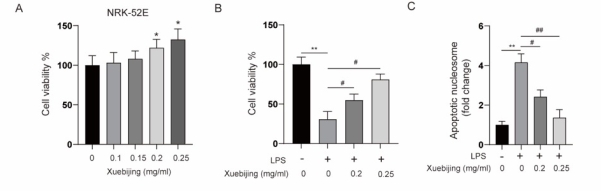

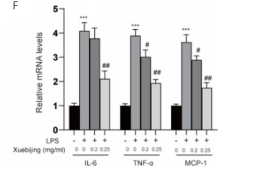
图2 NRK-52E细胞经LPS刺激后加入不同浓度血必净处理后各组比较
A用不同浓度的血必净处理完NRK-52E细胞24小时后,MTT法检测细胞活性。B.NRK-52E细胞用LPS (1ug/ml)和不同浓度的血必净(0.2mg/ml,0.25mg/ml)处理24小时后,MTT法检测细胞活性。C.NRK-52E细胞用LPS (1ug/ml)和不同浓度的血必净(0.2mg/ml, 0.25mg/ml)处理24小时后,利用Apoptotic Nucleosome ELISA 试剂盒检测细胞凋亡程度变化。D. NRK-52E细胞用LPS (1ug/ml)和不同浓度的血必净(0.2mg/ml,0.25mg/ml)处理24小时后,利用caspase-3 活性检测试剂盒检测caspase-3活性变化。E. NRK-52E细胞用LPS (1ug/ml)和不同浓度的血必净(0.2mg/ml,0.25mg/ml)处理24小时后,Western blotting检测培养基中炎症相关因子IL-6, TNF-a 蛋白水平变化。F. NRK-52E细胞用LPS (1ug/ml)和不同浓度的血必净(0.2mg/ml,0.25mg/ml)处理24小时后,ELISA法检测培养基中炎症相关因子IL-6,TNF-a mRNA水平变化。(注:与正常组相比,*P<0.05,**P<0.01,***P<0.001;与LPS组相比,#P<0.05,##P<0.01)
2.3 血必净对肾小管上皮细胞NRK-52E氧自由基的作用
与LPS组细胞比较,血必净组细胞GSH、SOD水平较高,而ROS、MDA水平较低(P<0.05)。因此血必净可以减少氧化自由基对肾小管上皮细胞NRK-52E的损伤。(见图3)

图 3. NRK-52E细胞经LPS及不同浓度血必净处理后氧化自由基水平比较
A.NRK-52E细胞用LPS (1ug/ml)和不同浓度的血必净(0.2mg/ml,0.25mg/ml)处理24小时后,利用试剂盒检测ROS水平的变化。B. NRK-52E细胞用LPS (1ug/ml)和不同浓度的血必净(0.2mg/ml,0.25mg/ml)处理24小时后,利用试剂盒检测MDA水平的变化。C. NRK-52E细胞用LPS (1ug/ml)和不同浓度的血必净(0.2mg/ml,0.25mg/ml)处理24小时后,利用试剂盒检测SOD水平的变化。D.NRK-52E细胞用LPS (1ug/ml)和不同浓度的血必净(0.2mg/ml,0.25mg/ml)处理24小时后,利用试剂盒检测GSH活力水平的变化。(注:与正常组相比,*P<0.05,**P<0.01;与LPS组相比,#P<0.05,##P<0.01)
3 讨论
脓毒症是一种临床诊断、治疗难度较大的全身细菌感染性疾病,近年来,随着我国人口老龄化现象的不断发展,我国脓毒症发病率连年上升,引起广大专家学者的关注[8-9]。脓毒症患者若得不到及时有效的治疗,病情不断恶化,可能会出现一系列的并发症致使多组织器官功能障碍甚至衰竭,严重威胁患者预后。急性肾损伤是一种临床常见的继发于脓毒症的综合征,据相关流行病学调查数据显示,50%左右的急性肾损伤患者继发于脓毒症,脓毒症相关急性肾损伤病情严重程度较高,临床治疗难度较大,极易发生机体多器官功能衰竭现象,致使病死率高达50%左右,因此越来越多的专家学者开始致力于脓毒症相关急性肾损伤病情控制、临床治疗、预后改善的研究[10-11]。血必净注射液主要由红花、赤芍、川穹、丹参、当归共五味中药组成,用于温热类疾病,具有化瘀解毒、体外拮抗内毒素的作用,常用于感染引起的全身炎性反应综合征、多器官功能失调综合征的治疗[12]。大量研究表示,血必净注射液用于脓毒症的治疗,具有一定的应用价值,还有研究表示线粒体功能障碍是脓毒症肾损伤的主要影响因素,但是关于血必净注射液对线粒体功能障碍调控作用的研究还鲜有报道。
脓毒症相关急性肾损伤的发生发展与机体肾组织细胞炎症反应、氧化应激损伤密切相关[13-14]。IL-6、TNF-α为广谱炎症因子,二者水平变化与炎症反应密切相关[15-16]。GSH、SOD是常用的体现机体氧化应激反应严重程度的指标[17-18]。本文研究结果显示,使用血必净注射液对LPS处理的肾小管上皮细胞进行干预,IL-6、TNF-α、GSH、SOD水平受到明显调控,出现这一研究结果的原因可能是使用血必净注射液进行干预,能够减轻LPS处理的肾小管上皮细胞炎症反应及氧化应激反应严重程度,从而对肾小管上皮细胞起到保护作用
脓毒症相关急性肾损伤的发生发展伴随着机体肾组织细胞凋亡、坏死,因此,抑制肾组织细胞凋亡是治疗急性肾损伤,发挥肾脏保护作用的关键。本文研究结果显示,使用血必净注射液对LPS处理的肾小管上皮细胞进行干预,细胞增殖率上升,凋亡率下降,说明使用血必净注射液进行干预能够抑制肾小管上皮细胞凋亡,从而发挥肾脏保护作用,而出现这一研究结果的原因可能是使用血必净注射液进行干预对细胞自噬、凋亡相关蛋白表达产生了调控作用,起到了抑制肾小管上皮细胞自噬、凋亡的作用。
caspase3作为caspase家族重要成员,其表达变化与癌组织细胞凋亡能力变化密切相关。本文研究结果显示,使用血必净注射液对LPS处理的肾小管上皮细胞进行干预,caspase3表达上调,说明使用血必净注射液进行干预能够调控细胞线粒体凋亡通路蛋白表达,抑制肾小管上皮细胞凋亡,从而对肾小管上皮细胞起到一定的保护作用。
综上所述,使用血必净注射液对LPS处理的肾小管上皮细胞进行干预,能够减轻炎症反应、氧化应激损伤,促进肾小管上皮细胞增殖,抑制肾小管上皮细胞凋亡,其作用机制可能为使用血必净注射液进行干预能够调控线粒体凋亡通路相关蛋白表达,从而在脓毒症相关急性肾损伤中起到肾脏保护作用。
参考文献
[1]梁维,赵静,冯玲, 等.脓毒症合并早期急性肾损伤患者sTREM-1、Ang-2及PCT水平变化及其与预后相关性分析[J].解放军医药杂志,2020,32(1):60-63.
[2]Antal O, Ștefănescu E, Mleșnițe M, et al. Hemodynamic Predictors for Sepsis-Induced Acute Kidney Injury: A Preliminary Study. J Clin Med. 2020 Jan 6;9(1):151.
[3]龙邦盛,王振贤,林莉娴, 等.菖蒲郁金汤联合CRRT疗法对脓毒症急性肾损伤免疫功能及PCT、CRP的影响[J].吉林中医药,2020,40(6):762-765.
[4]胡晓宁,王佳,耿静, 等.脓毒症致急性肾损伤患者miR-142-3p与PCT的关系及预测病死率的价值[J].临床急诊杂志,2020,21(1):38-42.
[5]Liu J, Zhao N, Shi G, et al. Geniposide ameliorated sepsis-induced acute kidney injury by activating PPARγ. Aging (Albany NY). 2020 Nov 10;12(22):22744-22758.
[6]刘岩,任思思,马秋晟, 等.血清miR-10 a、IL-35水平对脓毒症并发急性肾损伤的诊断效能[J].山东医药,2020,60(9):44-47.
[7]刘远波,曾明昊,黄一洪.血必净治疗脓毒症合并急性肾损伤的研究进展[J].广西医学,2020,42(10):1299-1302.
[8]Wang X, Wang Y, Kong M, et al. MiR-22-3p suppresses sepsis-induced acute kidney injury by targeting PTEN. Biosci Rep. 2020 Jun 26;40(6):BSR20200527.
[9]郭妍妍,曹延会.液体正平衡对严重脓毒症性急性肾损伤预后的影响[J].中华保健医学杂志,2020,22(1):9-11.
[10]Liu Y, Xiao J, Sun J, et al. ATG7 promotes autophagy in sepsis‑induced acute kidney injury and is inhibited by miR‑526b. Mol Med Rep. 2020 May;21(5):2193-2201.
[11]Lu SJ, Xu JH, He ZF, et al. Innate immune molecule surfactant protein D attenuates sepsis-induced acute kidney injury through modulating apoptosis and NFκB-mediated inflammation. Int Wound J. 2020 Feb;17(1):100-106.
[12]赵莉.血必净联合连续性肾脏替代治疗在脓毒症合并急性肾损伤患者中的应用效果[J].中国民康医学,2020,32(10):18-20.
[13]艾晨牧,雷小保,李桂成, 等.GLP-1受体通过SIRT3减轻脓毒症急性肾损伤炎症反应及细胞凋亡[J].热带医学杂志,2020,20(7):870-874.
[14]高友光,林献忠,曾振华, 等.虎杖苷对脓毒症急性肾损伤大鼠炎症反应和氧化应激的影响[J].临床麻醉学杂志,2017,33(6):584-587.
[15]王俊聪,袁园.CRRT对脓毒症合并急性肾损伤患者血清CRP、IL-6、 IL-10、KIM-1水平的影响[J].现代实用医学,2020,32(8):895-897.
[16]唐纪文,林秀娟,陈国胜, 等.血必净注射液治疗脓毒症急性肾损伤的疗效及对患者血清IL-6、TNF-α水平的影响[J].海南医学,2014,(15):2237-2239.
[17]黄杨,陈威,伍国宝.丹红注射液对脓毒症致急性肾损伤小鼠肾组织线粒体损伤和HMGB1表达水平的影响[J].临床和实验医学杂志,2019,18(24):2593-2597.
[18]袁晓红,李鹏,李雯, 等.清热解毒化瘀汤联合前列腺素E对脓毒症致 急性肾损伤患者机体氧化应激及血清 相关细胞因子水平的影响[J].现代中西医结合杂志,2019,28(36):4042-4046.
作者简介:通讯作者:黄静静(1980-),女,浙江宁波人,在职硕士,副主任医师。
基金项目:镇海区科技局公益类项目 编号:2020006